
Cours d’hydrochimie intégré pour licence
Exercice 1
L’Analyse chimique des eaux prélevées des puits du bassin d’une région de Guelma, a donné les résultat suivants ‘mg/l .
n TDS pH CE Ca Mg Na K HCO3 Cl PO4 NO3
1 656 7.40 649 106 35 44 0.82 312 42.6 0 17.6
2 1063 7.04 1093 188 30 76 0.43 331 107 0.02 29
3 702 7.50 627 99 31 72 0.55 372 56 0.14 10
4 1340 7.80 1537 202 60 98 0.29 326 199 0 23
5 703 7.85 589 100 29 69 0.41 362 42 0.15 15.30
6 637 7.33 639 99 26 48 0.47 356 42.60 0.18 9
7 671 7.03 590 94 32 66 0.74 312 43 0.14 10
8 712 7.12 644 110 32 56 0.65 311 36 0.13 8.90
9 538 7.55 743 102 18.26 18.70 1 240.20 89 1 32
10 572 7.43 865 78 15 100 0.25 200 102 0.10 15
Questions
a- Déterminer les différents facies de ces eaux à l’aide de la formule ionique
b- Déterminer les différents facies de ces eaux à l’aide du diagramme de Piper, Schoeller- Berkaloff, chaddaj et stiff.
c- Reconstruire hypothétiquement les sels dissous
d- Ces eaux sont –elles apte l’alimentation humaine et domestique.
Solution
Tout d’abord, il faut déterminer la balance ionique de chaque analyse pour mettre en évidence la rentabilité de la campagne de prélèvement.
Bi
Pour le calcul de ∑r+ ∑r- et ∑r
La balance ionique calculée pour les différentes analyses est inférieure à 5% ce qui traduit la rentabilité de la campagne de prélèvement (voir tableau ci-dessus). A ce stade-là, nous pouvons répondre à nos questions.
b- Détermination des facies à l’aide de la formule ionique
Il s’agit de classer les anions et les cations par ordre décroissants
rCl r SO 2-4 rHCO-3
rCa2+ r Mg2+ r Na+
Le facies est chloruré calcique (voir cours)
C -DETERMINATION DES FACIES A L’AIDE DES DIFFERENTS DIAGRAMMES
Digramme de Piper
Le diagramme de Piper utilise les éléments majeurs pour représenter les différents faciès des eaux souterraines. Il permet aussi d'où alors l'évolution d'une eau, passant d'un faciès a un autre, grâce à des analyses espacées dans le temps ou des analyses d'échantillons pris a des lieux différents. Le diagramme de Piper est particulièrement utile pour représenter toutes autres sortes de groupes d'analyses. Le diagramme de Piper se compose de deux triangles et un losange. Les deux triangles (un triangle portant les cations et un autre les anions) sont en premier lieu remplis puis ensuite le losange. Les valeurs utilisées sont exprimées en %. meq. L-1. La projection d’un nombre important d’analyse est trop fastidieuse de ce fait on a recours à l’utilisation des logiciels par exemple diagramme qui est téléchargeable gratuitement.
La lecture des différents facie se fait à partir du losange. Dans notre cas on a :
Les points en marron ayant un faciès bicarbonate calcique et bicarbonate magnésien
Les points en vert ayant un faciès chloruré sulfate calcique
Les points jaunes Na-Cl et CaMg
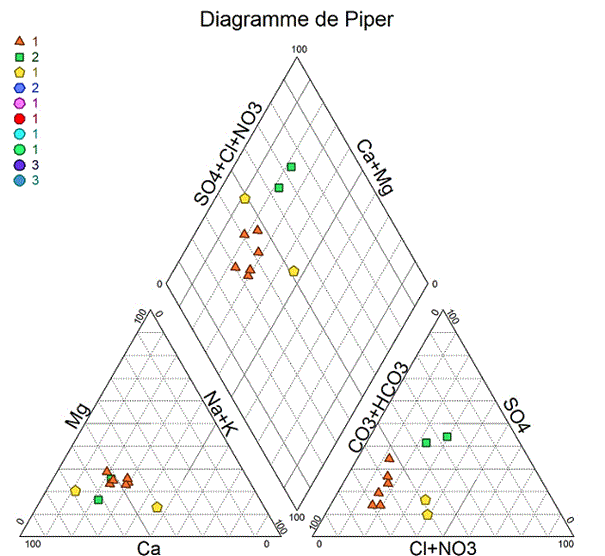
Diagramme Schoeller- Berkallof
Le diagramme de Schoeller- Berkallof permet entre autres de reconnaître simplement le faciès d'une eau souterraine, en utilisant les concentrations des éléments majeurs et en les reportant sur un graphique en colonnes à échelles logarithmiques ou en mgL-1. Plus le nombre d’analyse est important plus le diagramme en bâtonnet sera encombré et la lecture se fait correctement. La lecture du facies se fait en prenant le cation et l’anion dont la concentration est la plus élevée. Il en ressort de ce diagramme trois facies (figure ci-dessous) , bicarbonate calcique , chloruré calcique , chloruré calco- magnésien.
.
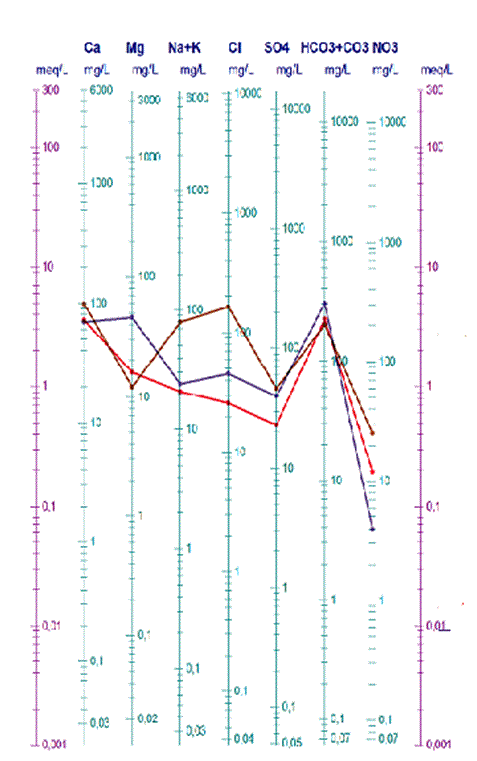
Diagramme de Chadha
Les processus hydrogéochimiques des eaux souterraines sont étudiés en projetant les concentrations ioniques des échantillons d'eau sur le diagramme de Chadha . Ce diagramme a été efficace dans plusieurs études à travers le monde pour établir les différents processus hydrogéochimiques. Le diagramme suggéré par peut classer l'eau en quatre types :
• Le groupe 1 caractérise la recharge type d’eau, Ca – HCO3
. • Le groupe 2 indique un excès de Ca – Mg – Cl, avec échange d'ions inversé.
• . Le groupe 3 décrit une eau saline riche en Na – Cl,
• Groupe 4 d'échange d'ions d'eau Na – HCO3.
En projetant les échantillons d'eaux s sur ce diagramme, nous observons que la majorité des échantillons tombent dans le groupe 2 (environ 60%), et le reste tombe dans le groupe 1 (30%) et le groupe 3 (10% de Le groupe 1 comprend des échantillons d'eau situés en amont de la zone, il caractérise la zone de recharge. Ces échantillons sont loin d'une source anthropique de pollution, ou situés à proximité de cours d'eau où il y a l'effet du processus de dilution. Eau classée comme un type d'eau à base de bicarbonate de calcium. Le groupe 2 se caractérise par des niveaux élevés de calcium et de magnésium par rapport au sodium et au potassium.
Mécanisme contrôlant le chimisme de l’eau
Le diagramme des Gibbs est largement utilisé pour mettre en évidence le chimisme influençant les eaux souterraines. Ce diagramme fait sortir 3 zones -a )- zone ou le chimisme est dominé par la dissolution des roches; -) zone b ou dominance de l’evapo-cristallisation, c zone c) dissolution par précipitation (pluie.)
Diagramme de Gibbs 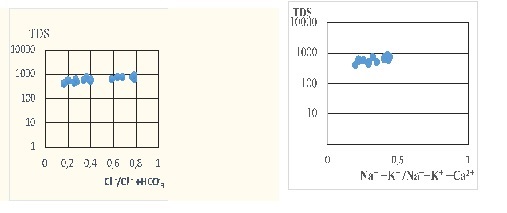
Indice de saturation
Les interactions entre les eaux souterraines et les roches hôtes environnantes seraient les principaux processus responsables des caractéristiques chimiques observées des eaux souterraines dans la zone d'étude. L'évaluation de ces processus nécessite la description du principal assemblage minéral des roches dans lesquelles se trouve l'eau et l’identification des réactions chimiques responsables de l'évolution géochimique des eaux souterraines. D'après les études disponibles dans la littérature, de telles réactions incluent généralement l'altération chimique des minéraux rocheux, la dissolution-précipitation des carbonates secondaires et l'échange d'ions entre l'eau et les minéraux argileux.
Par exemple; L’équilibre de CaCO3 , Ca2+ + CO-3 , le produit de l’activité ionique Ca2+ + CO-3 est une constante donnée à n’importe quelle température et est définie par la constante thermodynamique. KCaCO-3 (K calcite dans la matrice minéral), le degré de saturation calcite est défini par l’indice de saturation et donné par la relation suivante :
IS calcite = log10 [ (Ca2+) x (CO-3)] – log10 K calcite logarthme a la base 10
Où la saturation est déterminée à l’échelle logarithmique, est un degré de saturation dans les eaux naturelles variant par ordre de magnitude. Pour cette expression, la valeur de IS est égale à 0 correspond à la solubilité de la calcite dans l’état d’équilibre. Cependant les valeurs de +1 et –1 correspondent à 10 temps à 1/10 de temps de saturation respectivement. Les mêmes étapes sont applicables aux autres minéraux.
Ca Mg (CO3 ) + 2H+ → 2H+ + Mg2++ Ca2+ pour la dolomite
CaSO4 H2O→ Ca2+ + SO2-4 pour le gypse
L'indice de saturation (SI) est défini comme suit :
SI = log (PAI / KT)
où PAI est le produit d'activité ionique dans une réaction de dissolution minérale, qui peut être obtenu en multipliant le coefficient d'activité ionique γi et la concentration de composition mi ; et K est la constante d'équilibre de la dissolution des minéraux à 25 ° C. La simulation numérique pourrait être réalisée à l’aide du logiciel PHREEQ (Parkhurst et al., 1990).
Pression partielle en CO2
ORIGINES DU GAZ CARBONIQUE DANS LES EAUX SOUTERRAINES
Hormis l'origine magmatique qui vient d'être évoquée, on mentionne également l'existence de CO2 d'origine profonde, produit par métamorphisme des formations carbonatées, notamment à la périphérie des provinces volcaniques ; le dégagement de CO2 serait produit par des réactions de type,
CaCO3 + SiO2 <=> CaSiO3 + CO2 ∕ avec dégagement de CO2
Ces dégagements de gaz peuvent soit remonter directement jusqu'en surface sans relais ni stockage intermédiaire, soit être piégés dans des aquifères captifs de nature calcaire. Enfin, le CO2 peut être d'origine biogénique : dans les horizons superficiels, l'activité biologique de la faune et de la flore peut contribuer localement à la création de pressions partielles de CO2 dans les sols excédant nettement la pression de CO2 atmosphérique.
LE SYSTÈME CARBONATE :
RAPPELS THÉORIQUES
C'est l'ensemble formé par trois types de composés chimiques, qui sont : - dans l'atmosphère : le gaz carbonique (CO2) ; - dans l'eau : les composés de l'acide carbonique : H2CO3, HCO-3 (bicarbonates) et CO2-3 (carbonates) dans les roches : les minéraux carbonatés (surtout calcite, CaCO3, et dolomite, (Ca Mg (C03)2). Au contact entre eau et atmosphère, il peut y avoir dissolution ou dégazage de gaz carbonique. Au contact entre eau et roches, il peut se produire une dissolution ou une précipitation d’un minéral. C'est en ce sens que l'on peut définir l'ensemble de ces composés comme un système, puisque toute modification de l'un des termes entraîne des variations de chacun des autres.
Prenons un exemple qui peut être résumé par la réaction de dissolution de la calcite au contact d'une eau chargée en gaz carbonique.
CaCO3(s) + CO2(g) + H2O <=> Ca2+ + 2HCO–3
On peut définir des états d'équilibre (constante d'équilibre de la réaction).
VALEURS DE LA PRESSION PARTIELLE DE CO2 DANS LA NATURE
Actuellement, du fait de l'évolution des activités anthropiques (effet de serre) elle est en moyenne de 3,4 10-4 atm.
L’équilibre sera donné par la relation suivante :
CO2 (g) + H2O <=> H2CO3
Cet équilibre est réglé par la constante de Henry dont la valeur est donnée par la relation suivante :
K H= (H2 CO3) / pCO2 = 10-1.46
Cette valeur
est calculée à 25° et 1 atm. Cette
constante varie avec la température suivant l'expression empirique :
log KH = 1,46 + 0,0127 (t-25) avec t en ° Celsius
Destination de l’eau
L’usage de l’eau pour l’agriculture, l’industrie et l’alimentation en eau potable, dépend des conditions physico-chimiques des eaux rencontrées au niveau de telle région. De ce fait, nous comparons la composition de nos eaux aux normes.
On appelle norme Valeur guide recommandée par l'Organisation Mondiale de la Santé (OMS) visant à la protection de la santé publique, mais ne constituant pas des limites impératives. Les normes OMS sont destinées à servir de principes de base pour l'élaboration de normes nationales qui pour leur part prennent en compte les conditions environnementales, sociales, économiques et culturelles locales.
Norme OMS 2017
Paramètre limite désirable limite maximale non tolérée
pH 6.5 to 8.5 <6.5 and >8.5
TDS <500 mg/L >1500 mg/L
EC <1500 mS/cm >1500 mS/cm
Ca <75 mg/L >200 mg/L
Mg < 50 mg/L >150 mg/L
Na <200 mg/L >200 mg/L
K <10 mg/L >10 mg/L
HCO3 <300 mg/L >600 mg/L
Cl_ <200 mg/L > 2 00 mg/L
SO4 400 mg/L >400 mg/L
NO3 45 mg/L >45 mg/L
PO4 <0.3 mg/L >0.3 mg/L
F <1.5 mg/L >1.5 mg/L
|
Métaux lourds |
Norme ug/l |
|
Plomb |
10 |
|
Zinc |
3000 |
|
Cuivre |
1000 |
|
Fer |
300 |
|
Cadmium |
3 |
|
Chromates |
50 |
|
Manganèse |
50 |
TDS (Total dissolved salts) sels dissous totaux
TDS signifie total des solides dissous et représente la concentration totale des substances dissoutes dans l’eau. Le TDS est composé de sels inorganiques et de quelques matières organiques. Les sels inorganiques communs trouvés dans l’eau incluent le calcium, le magnésium, le potassium et le sodium qui sont tous des cations et des carbonates, nitrates, bicarbonates, chlorures et sulfates qui sont tous des anions.
Conductivite electrique
La classification de CE selon Saxena et al. 2004 ; Mondal et al. 2009). Les eaux souterraines et de surface peuvent être class » »es en 3 classe
- Eau fraiche CE inférieure à 1,500 uS/cm, (fresh water)
- Eau moyennement douce ‘brackish water’ CE -compris (1,500–3,000 uS/cm)
- Eau salée CE supérieure à 3,000 uS/cm). Saline water
Lire micro siemens
TDS (mg/l) Classification de (Freeze and Cherry 1979)
Inférieure à 1000 eau très douce
1,000–3,000 douce
3,000–10,000 médiocre
10,000–35,00 0 trop salée–
[35,000 très fortement salée
Titre hydrotimétrique (TH)
La
dureté de l'eau est définie comme l'inhibition de l'action du savon dans l'eau
en raison de la précipitation des sels de magnésium et de calcium tels que les
carbonates, les sulfates et les chlorures. Il peut s'agir d'une dureté
temporaire ou permanente. La dureté temporaire est principalement due à la
présence de carbonate de calcium et est éliminée par l'eau bouillante. La
dureté permanente est causée par la présence de chlorures et de sulfates de
calcium et de magnésium et ne peut être adoucie qu'avec des processus d'échange
d'ions.
La dureté de l'eau limite son utilisation à des fins industrielles ; elle provoque l'entartrage des chaudrons et des chaudières, la fermeture des tuyaux d'irrigation et peut causer des problèmes de santé aux humains comme l’insuffisance rénale. On peut la calculer comme suit
TH (Todd 1980):
TH (CaCO3) mg / l = 2,497 Ca2+ + 4.115 Mg2+
Les concentrations de Ca 2+ et Mg 2+ sont exprimées en mg / l. En tant que paramètre de qualité de l'eau, les valeurs TH peuvent être utilisées pour classer l'eau à des fins domestiques et industrielles.
TH (as CaCO3) mg/l = (Ca2+ + Mg2+) x_50 Sawyer and McCarty 1967
Ca2+ + Mg2 sont exprimés en meq/L
TH (as CaCO3) =(mg/l) (Sawyer
and McCarty 1967)
Inferieure .75 douce Soft
75–150 moyennement dure– moderatly hard
150–300 Dure hard
Superieure /300 tres dure very hard
Faire exercice du taleau 1
Usage agricole
SAR Sodium adsorption ratio
La concentration en sodium est un paramètre important dans hydrogéochimie des eaux souterraines. L'augmentation de la concentration en sodium affecte les propriétés du sol, ce qui entraîne une détérioration de la perméabilité du sol (Tijani 1994). La tendance du sodium à augmenter sa proportion sur les sites d'échange de cations au détriment d'autres types de cations estimée par le rapport de la teneur en sodium du calcium et du magnésium dans l'eau. Des ions sodium élevés dans l'eau affectent la perméabilité du sol et provoquent des problèmes d'infiltration et remplacent les ions calcium et magnésium adsorbés sur les argiles provoquent ainsi la dispersion des particules du sol. Cela entraîne à son tour la dégradation des agrégats du sol et devient dur lorsqu'il est sec et réduit les taux d'infiltration d'eau et d'air.
La raison d'utiliser le SAR est qu'il a une bonne corrélation au pourcentage de sodium échangeable et est beaucoup plus facile à calculer exactement. L'activité relative de l'ion sodium dans le processus d'échange est exprimée en termes de rapport (Todd 2007) connu sous le nom de SAR, qui est défini comme suit:
SAR = (Na+ +K+ ) / (Ca2+ +Mg2+ ) /2)1/2
où les concentrations ioniques sont exprimées en meq/L
Classification SAR (Bouwer 1978)
6–9 Increasing problem
9 Severe problem
Taux de sodium
Le pourcentage de sodium (Na%) est calculé en utilisant la formule donnée ci-dessous:
Na% = (Na+ + K+/ Ca2+ + Mg2+ + Na+ + K+) x100
où toutes les concentrations sont exprimées en meq / l.
Lorsque la concentration de sodium est élevée dans l'eau d'irrigation, les ions sodium ont tendance à être absorbés par les particules d'argile, déplaçant les ions Mg2 + et Ca2 +. Ce processus d'échange de Na + dans l'eau contre Ca2 + et Mg2 + dans le sol réduit la perméabilité et conduit finalement à un sol avec un mauvais drainage interne. Selon la classification de Wilcox (1955), on a ;
Na%)
<20 Excellent
20–40 bonne
40–60 admissible
60–80 médiocre
>80 inutilisable
Carbonate de sodium résiduel RSC (Residual sodium carbonate)
L’excès de carbonate et de bicarbonate de sodium dans les eaux souterraines par rapport à la teneur en calcium et enmagnésium influence également l'inadéquation d'eaux souterraines pour l'irrigation. Il s'agit de carbonate de sodium résiduel (RSC), qui est calculé comme suit (Ragunath 1987):
RSC= (HCO- 3 + CO2-3)- (Ca2+ + Mg2+)
Où les concentrations sont en meq /l..
<1.25 Bon
1,25-2,5 Douteux ou mauvaise
> 2,5 utilisable
Indice de permeabilte IP (Doneen 1964)
Les valeurs de l'indice de perméabilité (PI) indiquent également que l'eau souterraine convient à l'irrigation. Il est défini comme suit :
PI = (Na + + (HCO-3 )1/2 / (Ca2 + + Mg2 + + Na +)) x 100
PI < 60 utilisable pour l’irrigation
PI >60 Inutilisable pour l’irrigation
La projection des de la somme de ∑r en fonction de PI, on obtient le graphe de Doneen
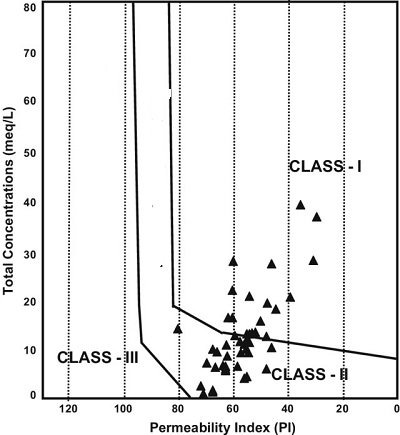
Diagramme de Doneen
Utilisation industrielle
Les eaux destinées à l’utilisation industrielle ne devraient être ni trop incrustantes ni agressives afin d’éviter le dépôt de tartre et la corrosion des circuits de canalisations et surtout des chaudières. Pour déterminer ces caractères, le calcul de l’équilibre calco-carbonique s’avère indispensable.
Equilibre calco-carbonique
Le ΔpH, est l’écart entre le pH mesuré et le pH de saturation théorique calculé à partir des teneurs en bicarbonates, sulfates, calcium et magnésium (Bakalowicz. M, 1979). Ce paramètre tient compte de l’ion calcium lié aux bicarbonates et aux sulfates.
pHm = pH mesuré et pHs = PH de saturation
Le calcul du ΔpH a été réalisé par le programme ( équil1) (Ravarini P, 2004). voir exercice
- معلم: TAHAR NOUAR